martes, 26 de octubre de 2010
Amenaza de Cierre del I.U.O
En Venezuela se esta presentando una situacion irregular. Se trata de bajar el nivel universitario de la carrera de OPTOMETRÍA a bachiller técnico, necesitamos apoyo. Si bien la carrera no se encuentra regulada en el país, la optometría ha tratado por casi 40 años de que el estado intervenga para regularizar la institución educativa y la profesión. En la actualidad la carrera se imparte a nivel universitario, el pensum actual es de cuatro años , un semestre basico, seis de curriculum regular y uno de trabajo comunitario, pasantía y tesis. El Estado Venezolano es el que está en mora con la profesión y con los usuarios de los servicios de salud visual. El IUO, unica institución de educación oprometrica en el país enfrenta amenaza de cierre por parte del Min. de Educación superior. Necesitamos tu apoyo.
martes, 21 de abril de 2009
Bienvenidos
En el texto deberan colocar su nombre completo y cedula de identidad. Es importante que lo hagan, ya que por esta via recibirán los materiales de estudio y las asignaciones de la Cátedra las cuales podrán enviar utilizando el mismo medio.
viernes, 1 de agosto de 2008
Clínica Integrativa de Atención Primaria
El pasado mes de julio culminó exitosamente sus actividades la primera cohorte de la CIAP "Clínica Integrativa de Atención Primaria" cuyo enfoque programático se fundamenta en el afianzamiento de conocimientos específicos, indefectiblemente actualizados, de manera integrativa, en la práctica, con pacientes y su aplicación en la conducta clínica regular. Esta cátedra propone el desarrollo de aptitudes que involucren al participante con el enfoque optométrico de atención primaria y sus implicaciones clínicas para posicionarlo como protagonista en este nivel de atención y especificidad.
El enfoque integrativo utilizado en esta cátedra la define como vehículo de reconcepción de los conocimientos y destrezas inherentes a la carrera con enfoque de atención primaria, asumiendo el alto nivel resolutivo que se requiere a este nivel de atención y contribuyendo efectivamente a desarrollar esta filosofía.
Los integrantes de esta primera cohorte son:
Romina Piedrasanta
Joan Berfon
Jorge Rodriguez
Yuliana Cedeño
Evelyn Tuarez
Daniela Escalante
Irvin Medero
Cesar Garcia
Raeliz Bello
Sus profesores Titular y auxiliares:
Optm Martín A. Guzmán H
Optm. Anayancy Rodriguez
Optm. Sirle Luna
Es para nosotros, sus fundadores, motivo de regocijo que nos encontremos en el eje de este hito histórico de la optometría venezolana.
jueves, 10 de abril de 2008
CARPE DIEM
Los invito a que vean esta profunda propuesta cinematográfica y a que se dejen inspirar por ella. Un amigo y colega solia tambien "plagiar" al gran Horatio su celebre frase. Espero que muchos más se unan a nosotros a este hermoso "plagio" que sin lugar a dudas cambia la realidad.
A continuación una breve explicación de la frase:
Carpe diem es una locución latina que literalmente significa ‘cosecha el día’, también significa ‘disfruta el día’, aunque lo que quiere decir es «aprovecha el dia, no lo malgastes» (que es distinto de disfrutarlo). Fue acuñada por el poeta romano Horacio (Odas, 11.8):
Carpe diem quam minimum credula postero
‘Aprovecha el día, no confíes en mañana’
Es un tópico literario, un tema recurrente en la literatura universal como una exhortación a no dejar pasar el tiempo que se nos ha brindado; o bien, para disfrutar los placeres de la vida dejando a un lado el futuro, que es incierto. Cobra especial importancia en el Barroco y Romanticismo. Asimismo se puede traducir como ‘aprovecha el momento’, ‘vive el momento’, es decir, «aprovecha la oportunidad y no esperes a mañana, porque puede ocurrir que mañana la oportunidad ya no exista».
Obtenido de "http://es.wikipedia.org/wiki/Carpe_diem"
La Historia Clínica
Ella es en si misma la herramienta mas compleja y la que requiere de mas experiencia clínica para que los resultados conduzcan al examinador a adoptar la conducta apropiada en cada uno de los casos.
En las profesiones del cuidado de la salud, la historia clínica constituye uno de los aspectos críticos de la evaluación, debido a que por las características y el foco de practica de este tipo de carrera se afrontan aspectos tan complejos como el diagnostico precoz de patologías lo que hace obligante que los aspectos subjetivos, del cuadro que este presente, sean abordados y desarrollados con lujo de detalles de manera que puedan ser comparados con los derivados de los procedimientos diagnósticos aplicados durante la evaluación.
Cada uno de nosotros (en un gran numero de casos) ejerce profesión de manera independiente y muy probablemente hemos tenido que diseñar nuestra propia historia clínica la cual poco a poco a medida que nos habituamos a su uso, nos damos cuenta de que nos faltan aspectos por desarrollar y que a veces “la historia se nos queda corta”.
La historia clínica es un procedimiento clínico complejo que requiere de la reunión de una serie de aspectos que deben ser tomados en cuenta, de manera que se pueda establecer una metodología apropiada para cada uno de los casos y a su vez estos puedan ser analizados siguiendo un criterio multifactorial.
Tanto las capacidades investigativas como las interpretativas deben ser debidamente desarrolladas por el clínico en aras de lograr interrelacionar la información recogida en la historia clínica con la inmensa variedad de patologías oculares y sistémicas que han sido documentadas hasta ahora. Estas habilidades solo pueden ser adquiridas por medio de una vasta experiencia con pacientes y en consultas en las que se pueda tener la oportunidad de ver una gran variedad de cuadros clínicos.
Por otro lado se presenta la disyuntiva de si estamos utilizando en la actualidad un formato de historia clínica que cumpla con los actuales fines de la optometría o si aun seguimos con el criterio uní factorial que se maneja aun en nuestro país.
También en este tema entra el aspecto académico de la profesión sin el cual la experiencia pierde todo sentido, en las profesiones de la salud mantenerse actualizado es una condición sine qua non para que el servicio que propendemos sea de la calidad que se merecen los habitantes de nuestra comunidad.
Es bastante común ver como profesionales y estudiantes subestiman la importancia de este procedimiento fundamental, dejando todo a las pruebas y evaluaciones objetivas esto se evidencia cuando el instructor clínico tiene que realizar una serie de preguntas adicionales al paciente después de que los estudiantes consideran que han terminado con la historia.
En la optometría de hoy en Venezuela, que se parece bastante a la de mediados del siglo XX en otros países, no se puede asumir la conducta que se pregonaba en las aulas donde muchos de nosotros nos formamos en la que se afirmaba que: “los optómetras trabajábamos en los ojos sanos”.
Por supuesto las cosas han cambiado hasta el punto de que lo que se tiene ahora como premisa es: “todo paciente esta enfermo hasta que se demuestre lo contrario”.
Si analizamos estos dos enunciados nos daremos cuenta de que el primero (arrastrado desde la década de los cincuenta hasta mediados de los noventa) aporta más limitaciones que oportunidades de que el acto optométrico se transforme en una acción de salud pública efectiva.
Por el contrario el segundo enunciado nos abre las puertas a la posibilidad de constituirnos en la puerta de entrada al sistema de salud.
Esta diferencia de criterio demuestra inequívocamente que el foco de practica es otro hoy y que el optómetra posee un gran variedad de nuevos conocimientos y dispone de procedimientos diagnósticos de alta tecnología que hacen de nuestra profesión un eje fundamental de a salud preventiva. Es por esta razón que la historia clínica seguida de los procedimientos indicados para cada caso individual y su interrelación constituyen una batería diagnostica tremendamente útil, tanto para el planteamiento de planes terapéuticos como para nuestra máxima profesional de este momento: el aumento del nivel resolutivo del sistema.
Retinoblastoma: diagnóstico, clasificación y tratamiento
(HEALTHIG News).- El Instituto Nacional del Cáncer norteamericano desarrolló un compendio informativo sobre el tratamiento del retinoblastoma. Se trata de un resumen panorámico de lo que es su pronóstico, diagnóstico, clasificación y tratamiento. El retinoblastoma es un tumor relativamente poco común en la niñez que aparece en la retina. La incidencia anual estimada está entre 1 en 15,000 y 1 en 34,000. Aunque puede ocurrir a cualquier edad, se presenta con mayor frecuencia en preescolares con un 80% de los casos diagnosticados antes de la edad de los 5 años. La presentación y el curso clínico en los pacientes mayores de 5 años de edad pueden diferir de los de pacientes más jóvenes. El tumor puede ser unilateral (70%) o bilateral (30%). El retinoblastoma se limita generalmente al ojo y, como resultado, más del 80% a 90% de los niños con retinoblastoma están libres de esta enfermedad 5 años después de ser diagnosticados. El retinoblastoma es un tumor que ocurre en forma hereditaria (40%) y no hereditaria (60%). La forma hereditaria puede manifestarse como enfermedad unilateral o bilateral. Generalmente la enfermedad unilateral no es hereditaria, mientras que toda la enfermedad bilateral es hereditaria. Los tumores hereditarios tienden a presentarse a una edad más temprana que los tumores no hereditarios, y los tumores unilaterales en niños pequeños tienen más probabilidad de tener mutaciones de línea germinal, mientras que los niños mayores tienen mayor probabilidad de tener tumores unilaterales. Los niños que padecen del tipo hereditario (historia familiar positiva o retinoblastoma bilateral o ambos, o mutaciones en el gen RB) que tienen un examen normal en al menos uno de los ojos al momento de la presentación inicial, necesitan ser revisados con frecuencia en busca de la aparición de nuevos tumores de retinoblastomas. Se recomienda que sean examinados cada 2 a 4 semanas por al menos 28 meses. Después del tratamiento, los pacientes requieren de una vigilancia cuidadosa hasta cumplir los 7 años de edad. Las supresiones o mutaciones del gen del "retinoblastoma" en la banda 14q del cromosoma 13 están altamente relacionadas a la predisposición del retinoblastoma. El retinoblastoma trilateral es un síndrome bien reconocido que consiste en retinoblastoma hereditario unilateral o bilateral asociado a un tumor neuroblástico intracranial. Se ha observado que entre el 5% y el 15% de los niños yas sea con retinoblastoma familiar, múltifocal, o bilateral podrían desarrollar de igual manera, un tumor neuroblástico intracraneal. Se ha indicado que los niños con retinoblastoma familiar, tienen particularmente una alta incidencia de retinoblastoma trilateral, y el retinoblastoma trilateral es casi siempre mortal También se ha descubierto que los pacientes que son asintomáticos al momento de ser diagnósticado con tumor intracraneal, gozan de una mejor supervivencia en sentido general, que aquellos pacientes sintomáticos. Los exámenes de detección mediante neuroimagenología podrían mejorar la tasa de curación si los casos de retinoblastomas trilateral se detectan durante el primer año después del diagnótico. Se ha recomendado que los niños con retinoblastoma de línea germinal se les practique un examen de detección cada tres meses durante el primer año después del diagnóstico, y al menos dos veces por año durante los tres años siguientes. Los pacientes con retinoblastoma de tipo hereditario, tienen una marcada frecuencia en el aumento de neoplasmas de malignidades secundarias (SMN, por sus siglas en inglés). La incidencia cumulativa es de alrededor de un 26% +/- 10%. Dentro de los no irradiados y 58% +/- 10% en los pacientes irradiados por 50 años después de un diagnóstico de retinoblastoma. La mayoría de los SMN en cánceres fueron osteosarcomas, sarcomas de tejido blando, o melanomas. El efecto carcinogénico de la radiación aumenta con la dosis. En los pacientes irradiados, dos tercios de los cánceres secundarios ocurren dentro del tejido irradiado y un tercio fuera del campo de radiación. El riesgo de SMN en el campo de radiación depende grandemente de la edad del paciente al momento de aplicar radiación de haz externo. Este riesgo podría ser menor en aquellos pacientes mayores de 12 meses de edad. Las malignidades secundarias deben ser tratadas con intención curativa. No existe un aumento claro en las malignidades secundarias en aquellos pacientes con retinoblastoma no hereditario. La orientación genética debe ser una parte integral de la terapia del paciente con retinoblastoma, ya sea unilateral o bilateral. Todos los hermanos de pacientes con retinoblastoma deberán ser examinados periódicamente, y algunos estudios sugieren que el análisis de polimorfismo del ADN puede emplearse para predecir qué personas están en riesgo y que se justifica que estén en estrecha observación. A veces se observan anormalidades citogenéticas (por ejemplo, supresión en el brazo largo del cromosoma 13). Existen servicios clínicos de laboratorio disponibles para realizar pruebas genéticas de parientes de pacientes con retinoblastoma para determinar el riesgo de susceptibilidad hereditaria a la enfermedad. A pesar de encontrarse confinado a la investigación, la secuencia "exón a exón" del gen RB1 demuestra mutación germinolineal en 90% de los pacientes con retinoblastoma hereditario. El tipo de tratamiento requerido depende tanto del grado de la enfermedad dentro del ojo, como de si la enfermedad se ha diseminado más allá del ojo, ya sea al cerebro o al resto del cuerpo. La mayoría de los pacientes con retinoblastoma tiene extensa enfermedad dentro del ojo al momento del diagnóstico con tumores masivos que afectan más de la mitad de la retina, tumores múltiples que afectan difusamente la retina, o impregnación obvia del humor vítreo. Las metas de la terapia tienen dos aspectos: curar la enfermedad y preservar tanta visión como sea posible. Clasificación celular El tumor está compuesto principalmente de células anaplásicas indiferenciadas que surgen de las capas nucleares de la retina. La histología muestra una semejanza al neuroblastoma y al meduloblastoma, que incluye agregación alrededor de los vasos sanguíneos, necrosis, calcificación y las rosetas de Flexner-Wintersteiner. Información de las etapas A pesar de que existen varios sistemas de clasificación actualmente disponibles para retinoblastoma, para los fines de tratamiento, el retinoblastoma se categoriza como enfermedad intraocular y extraocular. Intraocular Supervivencia libre de enfermedad a 5 años: >90% El retinoblastoma intraocular se localiza en el ojo y puede limitarse a la retina o puede extenderse afectando el globo; sin embargo, no se extiende más allá del ojo en los tejidos alrededor del ojo o a otras partes del cuerpo. Extraocular Supervivencia libre de enfermedad a 5 años: <10%> El retinoblastoma extraocular se ha extendido más allá del ojo. Puede limitarse a los tejidos alrededor del ojo, o puede haberse diseminado típicamente al sistema nervioso central (SNC) o a otras partes del cuerpo. Clasificación de Reese-Ellsworth para tumores intraoculares Reese y Ellsworth desarrollaron una clasificación generalmente adoptada de retinoblastoma intraocular y que ha demostrado tener importancia pronóstica en el mantenimiento de la vista y el control de la enfermedad local. El sistema se considera de importancia en las decisiones referentes al uso de modalidades locales de tratamiento. Grupo I: muy favorable para la conservación de la vista. Tumor solitario, de tamaño más pequeño que 4 diámetros discales, localizado en o detrás del ecuador. Tumores múltiples, ninguno mayor de 4 diámetros discales, localizados en o detrás del ecuador Grupo II: favorable para la conservación de la vista Tumor solitario, de 4-10 diámetros discales en tamaño, localizado en o detrás del ecuador. Tumores múltiples, de 4-10 diámetros discales en tamaño detrás del ecuador Grupo III: posible conservación de la vista. Cualquier lesión anterior al ecuador. Tumor solitario mayor de 10 diámetros discales detrás del ecuador Grupo IV: desfavorable para conservación de la vista. Tumores múltiples, algunos mayores de 10 diámetros discales. Cualquier lesión que se extiende anteriormente a la Ora Serrata Grupo V: muy desfavorable para la conservación de la vista. Tumores masivos que afectan más de la mitad de la retina. Siembra vítrea Nota: Aproximadamente 90% de los pacientes presentan enfermedad con uno o ambos ojos categorizados en el grupo V. Sistema clínico de clasificación del St. Jude Children's Research Hospital Un segundo sistema de clasificación es uno de los muchos sistemas propuestos de clasificación que intentan relacionar el grado de la enfermedad dentro y fuera del ojo con un pronóstico para la vista y con la liberación de la enfermedad sistémica. Este sistema está basado histológicamente y requiere enucleación; se puede usar con examen oftalmológico, con tomografía computarizada, y/o examen de imágenes por resonancia magnética. Etapa I: tumor limitado a la retina. Ocupa un cuadrante o menos. Ocupa dos cuadrantes o menos. Ocupa más del 50% de la superficie retinal Etapa II: tumor limitado al globo Con siembra vítrea Extensión a la cabeza del nervio óptico. Extensión a la coroides. Extensión a la coroides y a la cabeza del nervio óptico Extensión a los emisarios Etapa III: extensión regional extraocular del tumor. Extensión más allá de los extremos cortados del nervio óptico. Extensión a través de la esclerótica al contenido orbitario. Extensión a la coroides más allá del extremo cortado del nervio óptico (incluyendo extensión subaracnoidea). Extensión a través de la esclerótica al contenido orbitario y más allá del extremo cortado del nervio óptico (incluyendo extensión subaracnoidea) Etapa IV: metástasis distantes Extensión por el nervio óptico al cerebro (es decir, tumor macroscópico en el SNC o células tumorales en el líquido cefalorraquídeo) Metástasis hematógenas al tejido blando, hueso o vísceras. Metástasis a la médula ósea Nota: Aproximadamente el 80% de los pacientes presentan enfermedad en uno o ambos ojos clasificados en etapas I-II. Aspectos generales de las opciones de tratamiento Se requiere la planificación del tratamiento por un equipo multidisciplinario de especialistas en cáncer que tienen experiencia para tratar tumores oculares infantiles para determinar e implementar un tratamiento óptimo. Debido a la complejidad de la terapia, la pericia en radioterapia pediátrica y en oftalmología deberán estar a disposición. Retinoblastoma Intraocular El tratamiento para el retinoblastoma deberá planificarse después que se conozca el grado tumoral dentro y fuera del ojo. Las opciones de tratamiento consideran tanto la curación como la preservación de la vista. Las opciones de tratamiento para el ojo afectado son: Enucleación, si el tumor es masivo o si hay poca expectativa de mantener visión útil. Radiación con haz externo con dosis que varían de 3500 a 4600 cGy. Debido a la necesidad de sedar a niños pequeños y los detalles intrincados de la planificación de campos, es importante la pericia especial en radioterapia pediátrica. La crioterapia, que se usa además de radiación o en lugar de fotocoagulación en el caso de lesiones menores de 4 diámetros discales en la porción anterior de la retina. Ocasionalmente, se emplea sola la coagulación por luz (fotocoagulación) en tumores pequeños. En los pacientes con etapas tempranas de la enfermedad, generalmente se emplea la coagulación por luz además de radioterapia o donde hay recidiva limitada después de radioterapia. La fotocoagulación se emplea en tumores ubicados posteriormente que tienen menos de 4 diámetros discales, distintos de la cabeza del nervio óptico y la mácula, y sin afectar los vasos nutricios grandes o de la coroides. En algunas instituciones, la termoterapia llevada a cabo mediante radiación infraroja ha substituido a la fotocoagulación láser. Braquiterapia con placas radiactivas para las presentaciones focales unilaterales o para enfermedad recurrente después de irradiación previa con haz externo. Aún está bajo investigación, el uso de quimioterapia sistémica para reducir el volumen del tumor (quimioreducción) y para eludir los efectos a largo plazo ocasionados por la radioterapia en pacientes con tumores intraoculares que no son tratables mediante crioterapia, o fotocoagulación sola. Enfermedad unilateral Los pacientes con un solo ojo afectado, generalmente se encuentra que tienen afección masiva de ese ojo. Opciones de tratamiento Estándar: Puesto que la mayoría de las enfermedades unilaterales son generalmente masivas y a menudo no hay ninguna expectativa de preservar visión útil, usualmente se inicia cirugía (enucleación) y no se administra radioterapia a la base del tumor. Sin embargo, en los casos donde existe la posibilidad de preservar la visión debido a que los tumores son más pequeños, deberá considerarse tratamiento con otras modalidades (radioterapia, fotocoagulación, crioterapia, termoterapia y braquiterapia) en vez de cirugía. Ya que una proporción de niños que presentan retinoblastoma unilateral con el tiempo desarrollarán la misma enfermedad en el ojo opuesto, es muy importante que los niños con retinoblastoma unilateral sean examinados periódicamente del ojo no afectado. La enfermedad bilateral asincrónica ocurre más frecuentemente en familias en que los padres están afectados. Enfermedad bilateral El manejo de enfermedad bilateral depende del grado de la enfermedad en cada ojo. Opciones de tratamiento Estándar: Generalmente la enfermedad se encuentra más avanzada en un ojo, con menos afección del otro ojo. En el pasado el tratamiento estándar era la extirpación del globo ocular con mayor daño. Sin embargo, si existe la posibilidad de preservar la visión en ambos ojos, se indica efectuar irradiación bilateral prestando una particular atención a la respuesta, según se indica. Varios de los centros más grandes tanto en Europa como en Norteamérica, han comenzado a explorar la utilidad de la quimioterapia sistémica en pacientes cuyos tumores intraoculares no son factibles de un manejo local. ejemplos de tales tumores son aquellos demasiados grandes para ser tratados con crioterapia, fotocoagulación con rayos láser, o radioterapia con placa (braquiterapia). Otro ejemplo es el caso del recién nacido con un tumor sobre la cabeza del nervio óptico. Todas estas situaciones tienen en común la posibilidad de que la terapia local limite la visión de tal manera, que ofrezca muy poca ventaja sobre la extirpación del globo ocular. La mayoría de los centros han limitado este enfoque a los pacientes con enfermedad bilateral, al razonar que los pacientes con enfermedad unilateral, la morbilidad por extracción del globo ocular es de carácter modesto. Sin embargo, aun esto está siendo sometido a prueba, ya que los pacientes con enfermedad unilateral han sido tratados con quimioterapia en un intento por salvar el ojo con potencial de visión. Todos los protocolos institucionales pilotos, tienen en común el uso de carboplatino y etoposido. La mayoría de los centros añaden vincristina y uno de ellos promueve el uso de la ciclosporina A, como modulador de la glicoproteína P. En todos los casos, la meta de la quimioterapia es la reducción (de aquí el término "quimioreducción") del volumen tumoral, haciendo posible el uso de terapia local (crioterapia, fotocoagulación y radioterapia de placa) y evitando la extracción del globo ocular o la irradiación de haz externo. La quimioterapia ha sido combinada con terapia local con díodo de láser hipertérmico.Todos los centros que hasta la fecha nos informan, han mostrado que la meta a corto plazo es alcanzable, especialmente en aquellos tumores que son Reese-Ellsworth del grupo IV o menor, en el que se informa de respuestas en el 75% de los ojos. Los tumores del grupo V, particularmente aquellos con semilla vítrea, han demostrado ser problemáticos. El problema irresoluble es el control tumoral a largo plazo y las consecuencias de la quimioterapia. Todos estos pacientes están expuestos al etoposido, el cual ha sido relacionado a la leucemia secundaria en pacientes carentes de una predisposición al cáncer, pero a tasas moderadas cuando se le compara con el riesgo de irradiación de haz externo en el retinoblastoma germinal. Se desconoce si los pacientes con retinoblastoma de la línea germinal tienen una mayor susceptibilidad a los segundos tumores inducidos por la quimioterapia. Algunos pacientes tendrán progresión, y el riesgo de exposición tanto a la quimioterapia como a la irradiación en esta población, no ha sido determinado. Se estudia el establecer un experimento con múltiples centros participantes para confirmar las observaciones pilotos en pacientes en etapas iniciales, y probar el beneficio que pueda tener el añadir ciclosporina A, en los pacientes pertenecientes al grupo V. Retinoblastoma extraocular Un número reducido de pacientes con retinoblastoma presentan enfermedad extraocular. La enfermedad extraocular puede localizarse en los tejidos blandos que rodean el ojo o en el nervio óptico más allá del margen de resección. Sin embargo, puede ocurrir extensión adicional al cerebro y meninges con sembrado posterior en el líquido espinal, así como enfermedad metastática distante que afecta los pulmones, huesos y médula ósea. Opciones de tratamiento Estándar: No existe una terapia efectiva claramente probada para el tratamiento de retinoblastoma extraocular, aunque se han usado la irradiación orbital y la quimioterapia. En general, se ha usado terapia paliativa con radiación (incluyendo irradiación craneoespinal cuando hay afección meníngea) y/o quimioterapia intratecal con metotrexato, citarabina e hidrocortisona junto con asistencia médica de apoyo al paciente. En evaluación clínica: La meta principal de la terapia en pacientes con retinoblastoma extraocular es de mejorar la supervivencia desfavorable que se ha visto en el pasado. Además de radioterapia a la órbita, los siguientes enfoques están en evaluación: Quimioterapia sistémica. Los agentes usuales son vincristina, ciclofosfamida y doxorrubicina. Sin embargo, también se han usado carboplatino, ifosfamida, idarubicina, y etopósido, así como otros regímenes de combinación, que incluye el uso de quimioterapia de alta dosis con rescate de célula madre. No se ha probado el uso de coadyuvantes sistemáticos. Su uso como terapia inicial para enfermedad avanzada o en casos recidivantes en un entorno clínico es continuo. Quimioterapia intratecal en pacientes con la enfermedad en el sistema nervioso central o meníngeo. Los agentes más nuevos incluyen la diazicuona. Retinoblastoma recurrente El pronóstico para un paciente con retinoblastoma recidivante o progresivo depende del sitio y del grado de la recidiva o progresión. Se ha informado de respuestas tan elevadas como un 85% después de tratamiento con etopósido (VP-16) y carboplatino. Si la recidiva o la progresión de retinoblastoma se limita al ojo y es pequeña, el pronóstico para la vista y la supervivencia serán excelentes sólo con terapia local. Si la recidiva o progresión se limitan al ojo pero son extensas, el pronóstico para la vista será pobre; no obstante, la supervivencia continúa siendo excelente. Si la recidiva o la progresión es extraocular, entonces el pronóstico es probablemente menos del 50%. En esta circunstancia, el tratamiento dependerá de muchos factores y de las consideraciones individuales de cada paciente; el uso de pruebas clínicas puede ser un procedimiento adecuado y deberá considerarse. |
lunes, 17 de marzo de 2008
Resultados iguales con cirugía LASIK sin bisturí y LASIK normal con microqueratomo
La cirugía LASIK (queratomileusis in situ asistida por láser) se utiliza para tratar miopía, hipermetropía o astigmatismo mediante un cambio la forma de la córnea que altera la manera en la que el ojo refracta la luz. En la cirugía LASIK, se corta un colgajo del tejido corneal, luego se retira una cantidad previamente definida de ese tejido mediante un láser Excimer y finalmente se regresa el colgajo a su posición original. En la cirugía LASIK normal con microqueratomo mecánico, se corta el colgajo con un bisturí; mientras que en la cirugía LASIK sin bisturí, que es el tipo más nuevo, se crea el colgajo mediante un láser de femtosegundo.
"Seis meses después de la cirugía, no hay diferencia entre los ojos operados sin bisturí y los intervenidos con microqueratomo, en lo referente a agudeza visual (medir la visión para leer el cartel), sensibilidad al contraste (capacidad de diferenciar entre objetos claros y oscuros) o en la percepción de luz indirecta o de destellos de luz, como los faros de un vehículo que transita en sentido contrario", comenta el Dr. Sanjay Patel, oftalmólogo de la Mayo Clinic y uno de los investigadores.
Dada la equivalencia obtenida hasta ahora en los resultados para salud y visión ocular de ambos tipos de cirugías LASIK, el Dr. Patel se inclina más hacia aquella sin bisturí debido a su potencial de seguridad, cosa que no se midió en este estudio. "Diría que los resultados a corto plazo son iguales y, en teoría, los riesgos son menores con la técnica sin bisturí, aunque no diseñamos el estudio para comparar riesgos", agrega.
"La cirugía LASIK sin bisturí es potencialmente más segura gracias a su precisión controlada por computadora, a la capacidad de visualizar el colgajo que se corta, y a la posibilidad de detener el procedimiento en caso necesario. No obstante y a pesar de lo expuesto, el riesgo de complicaciones con la cirugía tradicional con bisturí o microqueratomo es muy bajo: en menos de uno por ciento de casos ocurre alguna pérdida de visión. De cualquier manera, aún se desconocen los riesgos a largo plazo de ambos procedimientos, y ese es el propósito fundamental de este estudio".
En el estudio se realizó el seguimiento a 20 pacientes sometidos a la cirugía LASIK debido a miopía o astigmatismo. A todos los pacientes se les practicó la cirugía LASIK con microqueratomo en un ojo y sin bisturí, en el otro. Los investigadores no encontraron diferencias en la densidad sub-basal del nervio entre los dos tipos de intervenciones quirúrgicas, aunque la densidad disminuyó después de ambos tratamientos en comparación con la existente antes de la cirugía LASIK. No hubo diferencias en la sensibilidad de la córnea entre la cirugía con microqueratomo y la sin bisturí. La densidad sub-basal del nervio y la sensibilidad de la córnea no afectan la visión, sino más bien la posibilidad del ojo para cicatrizar después de un rasguño u otra lesión. La agudeza visual de alto contraste, la capacidad de ver los detalles finos, la sensibilidad al contraste y la capacidad para percibir diferencias entre objetos y ambientes, no presentaron diferencias entre ambos tipos. Los investigadores descubrieron que la retrodispersión (backscatter) corneal fue mayor con la cirugía LASIK sin bisturí durante los primeros tres meses posteriores a la intervención quirúrgica, aunque los pacientes no notaban ninguna diferencia en la visión después de tres meses, entre el ojo operado por LASIK sin bisturí y el intervenido por LASIK con microqueratomo. La retrodispersión es una opacidad en la córnea que normalmente no se puede observar a simple vista y se identifica con el examen en el consultorio médico. La densidad celular en todas las capas de la córnea tampoco presentó variación entre los dos tipos de cirugía.
El objetivo final del estudio de la Mayo Clinic sobre la comparación entre las cirugías LASIK con microqueratomo y sin bisturí es obtener información a largo plazo respecto a la visión y salud ocular de los pacientes, cinco años después de la intervención. Los resultados que se presentan ahora corresponden a los hallazgos de los primeros seis meses.
También participaron en este estudio de la Mayo Clinic los siguientes investigadores: Cherie Nau y los doctores Jay McLaren, Jay C. Erie, Leo Maguire y William Bourne. Ninguno de los investigadores tiene intereses comerciales. El financiamiento para el estudio fue gracias a los Institutos Nacionales de Salud, la Investigación para Prevención de la Ceguera y la Mayo Clinic.
martes, 12 de febrero de 2008
GONIOSCOPY.ORG
Se presentan videos de la mayoría de las patologías relativas al glaucoma.
Abra el site en: www.gonioscopy.org
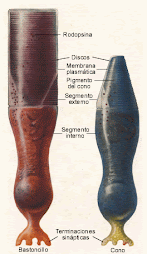
Atlas de Anatomia de Ojos de Cerdo
viernes, 8 de febrero de 2008
La biblioteca Optométrica de Indiana University
http://www.opt.indiana.edu/optlib/optlib.html
sábado, 2 de febrero de 2008
Descubren el origen de todos los ojos azules
31 de enero de 2008, 09:30 AM
(www.saludyciencias.com.ar * Por E.G.) Una investigación realizada en la Universidad de Copenhagen, en Dinamarca, precisó el origen histórico de la modificación genética que generó los ojos azules de todos los habitantes del planeta. Los científicos calculan que esta mutación evolutiva ocurrió entre 6 y 10.000 años atrás. Y de ese ancestro común descienden todos los hombre y mujeres de ojos azules de la Tierra.
El trabajo se publicó en la edición de enero de la revista científica Human Genetics e implicó analizar y comparar muestras ejemplares de ADN mitocondrial proveniente de personas de variados colores de ojos provenientes de diversos países.
Originalmente, las personas tenían los ojos marrones, afirmó el Profesor Hans Eiberg del Departmento de Medicina Celular y Molecular de la Universidad. Pero una modificación genética aleatoria afectó al gene conocido como OCA2 en el cromosoma humano y se generó una especie de interruptor biológico capaz de apagar el funcionamiento de otros genes que son los responsables de generar los ojos marrones.
Justamente, el gene OCA2 es el responsable de codificar la proteína denominada P, que está directamente relacionada con la producción de melanina, el pigmento que le da su color a la piel, el pelo y también los ojos.
El switch, que se encuentra físicamente cercano en los cromosomas- al gene OCA2 es capaz de moderar la producción de proteína P que termina en el iris de cada ojo y modela su color, sin impedir su producción total. Así con menos melanina se diluye el color marrón y va apareciendo el azul.
El albinismo
De hecho, cuando esto pasa y la función del OCA2 y la producción de la melanina es totalmente silenciada, prácticamente no hay generación de este pigmento y se produce la -no tan extraña- condición denominada albinismo.
Otro detalle que destacó Eiberg es que, según su opinión, esta mutación es relativamente neutra en términos de representar mejoras o desventajas en la carrera de la supervivencia genética y en la evolución. Algo similar a lo que ocurre con ser pelado, o tener algunas manchas en la piel. Es, simplemente, el resultado de las constante mutaciones aleatorias que prueba y descarta la madre naturalezajueves, 27 de diciembre de 2007
(Traducido y comentado por el Optm. Martín A. Guzmán H.)
Ahora, los investigadores del Glaucoma estan entendiendo mas sobre el estimulo y los mecanismos conducentes a la muerte de una célula ganglionar.
Este conocimiento puede llevar a inconmensurables avances en el uso de terapias neuroprotectoras.
PALABRAS CLAVE: Apoptosis, terapia neuroprotectora, flujo axoplásmico retrógrado, neurotrofina, glutamato, toxicidad, exitotoxina.
Para el optómetra en su rol de ente primario de atención visual y ocular, la detección precoz de patologías representa un aspecto critico, por lo que la tecnología y la investigación sirven para los que practicamos esta profesión de herramientas irremplazables para el desarrollo de técnicas y conocimientos que nos conduzcan a comprender mejor los mecanismos fisiopatológicos, también denominados historia natural de la enfermedad, involucrados en cuadros tan frecuentes en nuestras consultas como el glaucoma.
A continuación presentamos un extracto parcial del articulo Death of a Nerve Cell, publicado en la revista Review of Optometry en su entrega del mes de Julio de 1998 en el que se explica de una manera breve y comprensible el mecanismo de muerte celular en el glaucoma por apoptosis o suicidio celular.
La terapéutica tradicional del glaucoma tiene como meta, atenuar o contrarrestar lo que se piensa es el causante primario del glaucoma, la presión intraocular elevada. Mientras que este enfoque, el cual seguramente se mantendrá por años, como una de las principales reglas en el manejo del glaucoma, los investigadores han logrado llegar a entender mejor el proceso a través del cual, las células ganglionares de la retina mueren durante el proceso glaucomatoso. Gran parte de este trabajo, se encuentra todavía a nivel de ciencia básica y nadie se atreve a declarar ningún “descubrimiento” por el momento.
Sin embargo, los científicos estan dando grandes pasos hacia el desarrollo de tratamientos que puedan mantener las células ganglionares de la retina vivas y funcionando, incluso durante un episodio destructivo severo.
Según el Dr. B. Dreyer M.D., Ph.D., Codirector del Servicio de Glaucoma del Scheie Eye Institute of Philadelphia “La ciencia ha pasado 100 años trabajando para bajar la PIO, lo que indiscutiblemente se ha logrado, pero todavía hay pacientes que siguen perdiendo su visión a pesar de un excelente control de sus presiones intraoculares”.
El Dr. Dreyer y otros investigadores, estan a la búsqueda de tratamientos neuroprotectores, los cuales permitan, bien sea inhibir el estímulo inicial que desencadena la muerte de la célula nerviosa en el glaucoma, o impedir algunos de los aspectos de la subsecuente cascada apoptótica.
Este articulo presenta una breve descripción de lo que podríamos llamar la fisiopatología de la muerte de una célula ganglionar de la retina en el glaucoma y como este conocimiento puede llevar a desarrollar terapias neuroprotectoras útiles.
SUICIDIO CELULAR
Existe abundante evidencia experimental que indica que las células ganglionares en el glaucoma, desarrollan una suerte de muerte programada llamada apoptosis. Es una especie de suicidio celular, en el cual la célula por si sola genera los componentes genéticos necesarios para su propia destrucción.
El proceso de muerte celular apoptótica, según el Prof. Robert W. Nickells, Ph.D., es como sigue. Primero la célula recibe un estimulo para morir; en las células ganglionares de la retina, durante un estadío glaucomatoso en curso, dicho estímulo puede producirse bien sea, por deprivación de la neurotrofina (neurotrophin) o por toxicidad al glutamato.
El daño celular eventualmente activa una proteína denominada P53, esta proteína controla los niveles celulares de dos genes clave, uno que inhibe la apoptosis (VCL-2), y otra que promueve la muerte celular (VAX).
Estos genes en su momento afectan a otra proteína denominada citocromo C, el cual es liberado por las mitocondrias. Seguidamente se activan las proteasas denominadas caspasas, las cuales digieren los componentes celulares.
El debris residual de este proceso, es empacado en pequeñas vesículas las cuales eventualmente, son engullidas por células vecinas actuando como macrófagos sustitutos, sobreviniendo como resultado la muerte de la célula ganglionar.
Los dos estímulos considerados como clave para el proceso de la muerte celular (la deprivación de la neurotrofina y la toxicidad al glutamato), han atraído considerablemente la atención de los investigadores. Los científicos esperan desarrollar terapias efectivas para contrarrestar ambas situaciones.
Según el Dr. Nickells “si se pudiera bloquear el proceso de muerte celular por un periodo critico se podría revertir el efecto destructivo del proceso, de manera tal que las células experimenten mejoría y un poco mas tarde comiencen de nuevo a funcionar normalmente”. De esa manera se podría ganar tiempo logrando que el proceso de muerte celular pueda ser revertido”.
Para poder entender como podría funcionar un tratamiento neuroprotector en estos casos, seria de gran ayuda entender, como el estimulo desencadenante contribuye a la apoptosis en el glaucoma.
La deprivación de la neurotrofina
Como en la mayoría de las neuronas, las células ganglionares de la retina, requieren de factores de crecimiento para su sobrevivencia. Estos péptidos recubren la superficie de los receptores celulares y estimulan los eventos moleculares que afectan las funciones esenciales del metabolismo celular.
Uno de los factores clave en el crecimiento es una neurotrofina denominada “Factor Neurotrófico derivado del Cerebro” (BDNF por sus siglas en ingles, Brain Derived Neurotrofic Factor). Las células del cerebro liberan esta sustancia, la cual viaja por transporte axoplásmico retrogrado hacia la retina, lugar en el cual nutre a las células ganglionares.
Cualquier factor que interrumpa el transporte axoplásmico retrógrado hacia la retina, puede comprometer la integridad de las células ganglionares. Estudios en animales han demostrado que la transección del nervio óptico aparentemente interrumpe el suministro de BDNF y estimula la apoptosis. De la misma manera se ha determinado que la PIO elevada interrumpe dicho proceso tanto en humanos como en estudios experimentales de glaucoma.
Este proceso ocurre si el daño primario al nervio óptico es causado por isquemia o por compresión mecánica de las fibras.
Todavía no se sabe la extensión real del bloqueo axoplásmico, si este es reversible, ni tampoco cuanto tiempo puede sobrevivir una célula ganglionar con sus axones bloqueados en el glaucoma humano.
Se podría decir que existe una oportunidad esperanzadora de tratar las células afectadas antes de que ellas progresen ineluctablemente hacia la vía apoptótica.
La Toxicidad al glutamato
Una variedad de enfermedades neurológicas, incluyendo el glaucoma, se caracterizan por presentar altos niveles de neurotransmisores exitatorios, entre ellas el glutamato, la exitotoxina primaria del cerebro.
Estudios hechos en animales sugieren que la toxicidad al glutamato puede contribuir a la muerte de las células ganglionares en el glaucoma.
La toxicidad al glutamato constituye una respuesta primaria a la isquemia celular, hecho que soporta la existencia de un mecanismo isquémico en el proceso de daño al nervio óptico.
“La exitotoxicidad es un concepto en el cual se afirma que las neuronas son estimuladas para morir, principalmente por el glutamato, pero también es importante considerar otros aminoácidos exitatorios que también podrían jugar un papel en el proceso”, según comenta el Dr. Dreyer “ El glutamato involucra a un amplio espectro de fotorreceptores. Pero el malo de la película, el que es tóxico, es el receptor denominado NMTA o N-metil-D-aspartato”.
La sobreestimulación de este receptor dispara una cascada de eventos moleculares que conducen a la muerte celular, los canales de calcio en la membrana celular se abren, propiciando una sobrecarga de calcio. En algunas neuronas esto activa la enzima oxido-nitricosintasa, llevando a la formación de radicales libres destructivos. Un daño extenso producido por estos radicales mata a la célula.
Un estudio reciente en el cual se utilizaron ratas sugiere, que tanto la deprivación de neurotrofina como la toxicidad al glutamato, pueden contribuir a la muerte de las células ganglionares en dos diferentes fases. El primer período de muerte celular parece ser causado por el daño real a los axones (la deprivación de la neurotrofina), y que las neuronas que sobreviven ese evento, subsecuentemente mueren por una exposición aumentada al glutamato.
martes, 25 de diciembre de 2007
Clase Magistral de Anatomia Ocular
http://www.newmediamedicine.com/videos/2007/01/08/ucb-lecture-30-eye/